醫療器械臨床試驗在各國的法規注冊過程中,都是很重要的醫療器械注冊資料。目前國內醫療器械公司絕大多數沒有專題一頁的研發和法規團隊,因此對相關方面信息了解甚少,也無法根據相關要求規劃和指導研發、注冊工作。因此醫療器械臨床試驗實施是目前很多企業的難點工作,因此許多醫療器械公司會選擇奧咨達CRO服務,使得申辦方更專業、更有效、更易成功以及更能降低成本的完成此項工作。
1)在中國NMPA注冊沒有在豁免醫療器械產品目錄中的的二三類醫療器械產品都必須要進行醫療器械臨床試驗(即臨床驗證);
2)美國的很多產品根據美國的標準和相應的法規指南文件,也需要開展醫療器械臨床試驗,臨床試驗資料作為FDA 510k或者PMA注冊認證的必須文檔之一;
3)歐盟的部分產品,包括很多IIb以及III類的產品,都需要臨床試驗資料;歐盟的體外診斷產品,根據IVDD指令的要求。特別是List A和list B 的很多產品,都必須開展臨床試驗。
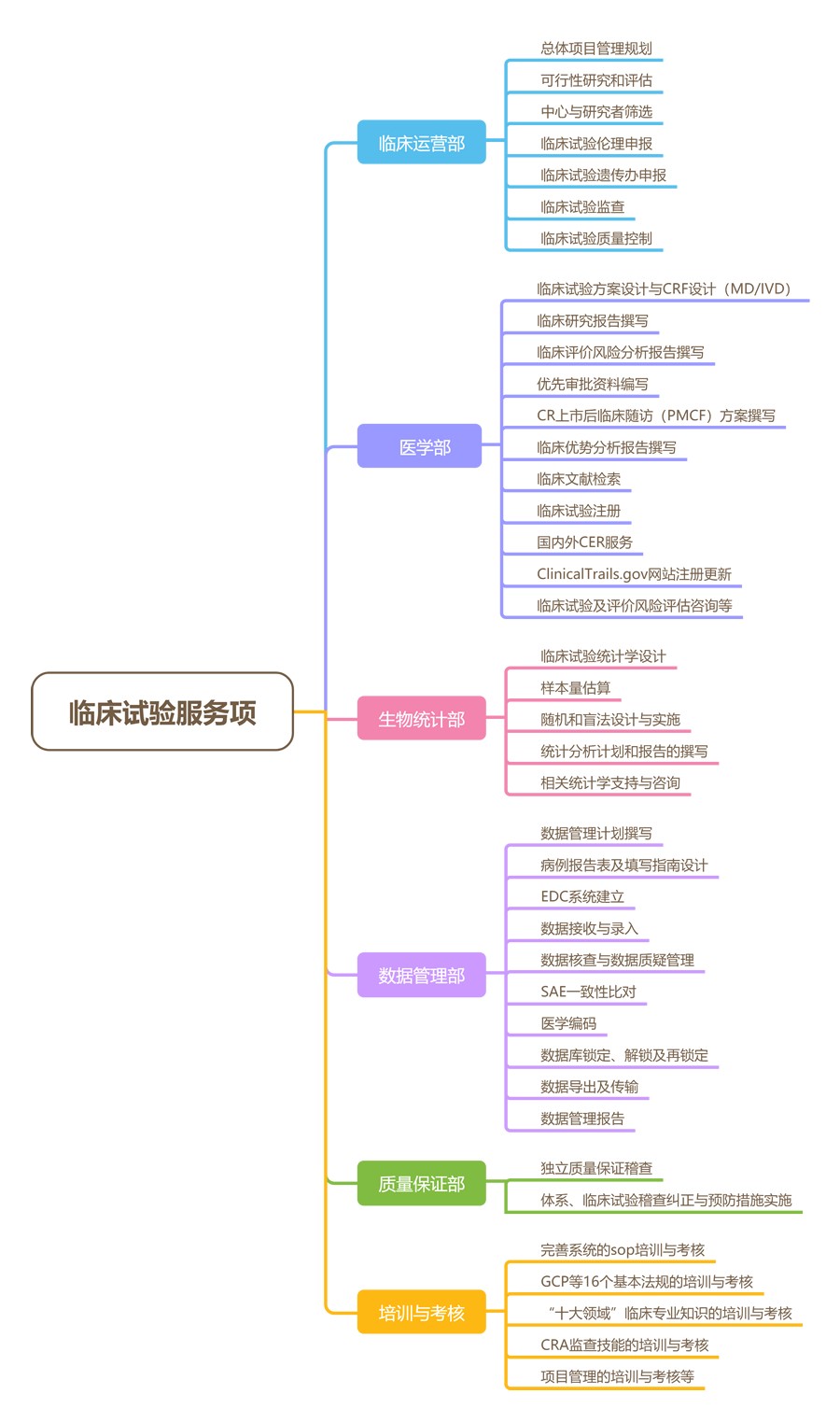
奧咨達臨床試驗服務如下:
準備好開始了嗎?
那就與我們取得聯系吧
有一個醫療器械項目想和我們談談嗎?您可以填寫右邊的表格,讓我們了解您的項目需求,這是一個良好的開始,我們將會盡快與你取得聯系。當然也歡迎您給我們寫信或是打電話,讓我們聽到你的聲音!
24小時免費咨詢熱線:
400-6768632