奧咨達提供全方位、一站式的醫療器械臨床試驗方記錄、數據和報告服務:
服務項目:
1.編寫臨床試驗方案
2.臨床試驗模擬核查和檢查
3.醫療器械臨床試驗研究者手冊編寫
4.醫療器械臨床試驗實施數據管理
5.醫療器械臨床試驗報告編寫
6.醫療器械臨床試驗法規咨詢培訓
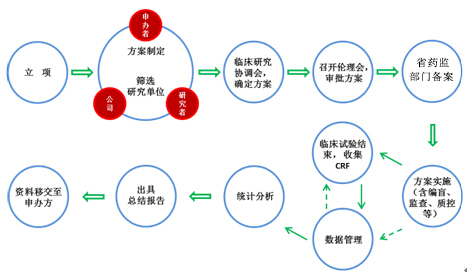
企業在臨床試驗中,臨床基地主要臨床試驗研究者應當確保將任何觀察與發現均正確完整地予以記錄,并認真填寫病例報告表。我們將協助審核研究者填寫的記錄是否完善,至少需要包括以下內容:
(一)所使用的試驗用醫療器械的信息,包括名稱、型號、規格、接收日期、批號或者系列號等;
(二)每個受試者相關的病史以及病情進展等醫療記錄、護理記錄等;
(三)每個受試者使用試驗用醫療器械的記錄,包括每次使用的日期、時間、試驗用醫療器械的狀態等;
(四)記錄者的簽名以及日期。
作為臨床試驗的申辦者(企業)應當準確、完整地記錄與臨床試驗相關的信息,內容至少包括:
(一)試驗用醫療器械運送和處理記錄,包括名稱、型號、規格、批號或者序列號,接收人的姓名、地址,運送日期,退回維修或者臨床試驗后醫療器械樣品回收與處置日期、原因和處理方法等;
(二)與臨床試驗機構簽訂的協議;
(三)監查報告、核查報告;
(四)嚴重不良事件和可能導致嚴重不良事件的器械缺陷的記錄與報告。
臨床試驗報告的主要內容包括:
(一)一般信息;
(二)摘要;
(三)簡介;
(四)臨床試驗目的;
(五)臨床試驗方法;
(六)臨床試驗內容;
(七)臨床一般資料;
(八)試驗用醫療器械和對照用醫療器械或者對照診療方法;
(九)所采用的統計分析方法以及評價方法;
(十)臨床評價標準;
(十一)臨床試驗的組織結構;
(十二)倫理情況說明;
(十三)臨床試驗結果;
(十四)臨床試驗中發現的不良事件以及其處理情況;
(十五)臨床試驗結果分析、討論,尤其是適應癥、適用范圍、禁忌癥和注意事項;
(十六)臨床試驗結論;
(十七)存在問題以及改進建議;
(十八)試驗人員名單;
(十九)其他需要說明的情況。
臨床試驗報告應當由研究者簽名、注明日期,經臨床試驗機構醫療器械臨床試驗管理部門審核出具意見、注明日期并加蓋臨床試驗機構印章后交申辦者。
多中心臨床試驗中,各分中心臨床試驗小結應當由該中心的研究者簽名并注明日期,經該中心的醫療器械臨床試驗管理部門審核、注明日期并加蓋臨床試驗機構印章后交牽頭單位。
準備好開始了嗎?
那就與我們取得聯系吧
有一個醫療器械項目想和我們談談嗎?您可以填寫右邊的表格,讓我們了解您的項目需求,這是一個良好的開始,我們將會盡快與你取得聯系。當然也歡迎您給我們寫信或是打電話,讓我們聽到你的聲音!
24小時免費咨詢熱線:
400-6768632